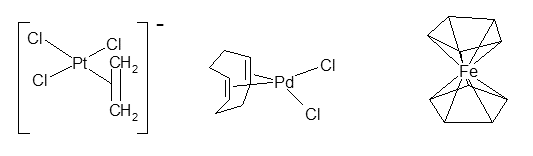
アルキル錯体
アルキル基が金属に単結合を介して結合した錯体です。ここでアルキル基部分は形式的には−1価の配位子として作用することに注意してください。例えば[Mn(CO)5(CH3)]ではマンガンの酸化数は+1,[Re(CH3)6]ではレニウムの酸化数は+6となります。典型元素のアルキル錯体は単純な化合物が多数知られています。
CH3Li メチルリチウム
CH3CH2MgBr エチルグリニャール
Pb(CH3)4 テトラメチル鉛 昔ハイオクガソリンに使われた
Sn(CH3)4
これらは通常の配位子と同じような配位結合として理解できます。つまり:CH3−アニオンが金属に配位結合によって結合すると考えることができます。
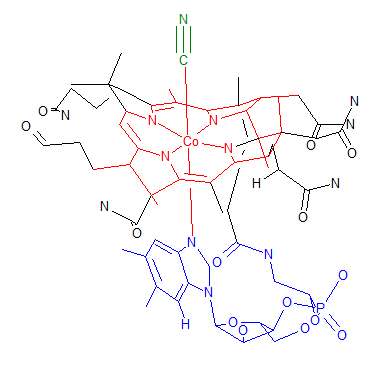
1830年ころ、デンマークの化学者Zeiseは、エチレンを含む不思議な白金化合物K[PtCl3(CH2=CH2)]を合成しました。この化合物の構造は長い間未知のままであったが、ついに20世紀半ばになって下図左に示すようにエチレンが白金に2重結合の部分で結合していることが分かりました。今日多くの錯体が合成され、他の錯体の合成原料などにも使われています。下図真ん中はシクロオクタジエンが金属に結合したものです。
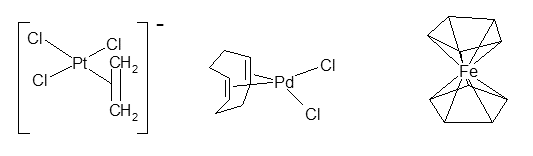
1950年代にシクロペンタジエンから水素イオンが1つ抜けたシクロペンタジエニルイオン(陰イオン)が鉄に2つ配位した、サンドイッチ型の化合物が合成されました。鉄の酸化数は+2であり、フェロセンと呼ばれています。(上図右端)
COは多くの金属に配位することが知られています。。有名なのはテトラカルボニルニッケル(右端)で、ニッケルの酸化数は0となります。この化合物は液体(沸点43℃)で、猛毒です。図にはそのほかクロム、鉄のカルボニル錯体をあげました。すべて金属の酸化数は0です。
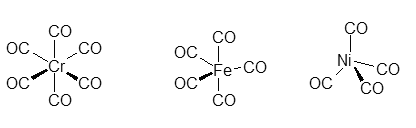
体の中にコバルトはmg程度あるとされています。通常ビタミンB12は図に示したシアノコバラミンと呼ばれる分子で、コバルトにCNが結合しています。ビタミンB12は体の中では有機金属錯体に変わり(右図のアデノシンの結合したもの)、補酵素として代謝に関係している。有機金属錯体が体内で働いている珍しい例です。