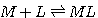 (3)
(3) 錯体の代表的な反応には配位子置換反応と酸化還元反応があります.
これは錯体に結合している配位子が別の配位子と置き換わる反応のことです.この理解のための重要なポイントは3つあります.1つは「金属イオン」というのは溶液中ではたいてい溶媒が配位しているので,【金属イオンに配位子が結合する反応】(反応式1)は,実際には【配位している溶媒と配位子が置き代わる置換反応】(2)と理解すべきという点です.
M + L → ML (1)
[MS6]n+ + L → [MLS5]n+ + S (2)
なお,(2)式では金属のまわりの溶媒Sは6個であると仮定しています.Sが一個取れて,代わりにLが結合したという反応です.
2つ目は金属には置換活性なものとそうでないもの(置換不活性)があるということです.置換活性な金属とは金属と配位子の結合が切れやすく,ある配位子が結合していても別の,より結合しやすい(次に説明する安定度定数の大きな)配位子が来るとすぐにそれと置き換わってしまう金属のことです.置換不活性なものはそれと逆で簡単には配位子置換反応が起こらない金属を言います.有機化学の常識では普通炭素周りの結合が簡単に切れることはないので,置換活性な金属の反応は錯体に特有のものと言えましょう.実際には金属の置換反応の速度は様々であり (表を参照)反応が1分程度より早く起こる場合を置換活性,それより遅い場合を不活性と呼んでいることが多いと思います. 置換活性の場合は,ともかく金属に配位子を混ぜればいいので,ある意味合成も簡単ですが,異なる種類の配位子を含む錯体を合成しようとしても,結局ある配位子だけ含む錯体になってしまったり,異性体を作り分けようと思っても1つの異性体しか取れなかったりします.異性体の研究をするためには通常置換不活性な金属を用いなければなりません.
| 置換反応速度 | 金属種の例 | 分類 |
|
<10-9s |
Li+, Na+、K+, Ca2+, Sr2+, Ba2+, Cd2+, Cu2+ |
置換活性 |
|
10-6−10-8s |
Mn2+, Zn2+, La3+ |
置換活性 |
|
10-4−10-6s |
Ni2+, Mg2+ , Co2+, Fe2+ |
置換活性 |
|
>103s |
Cr3+, Co3+,Ru2+, Rh3+, Ir3+, Pt2+ |
置換不活性 |
3つ目は安定度定数であり,これは配位子と金属の結合の強さを表す尺度の1つです.(3)式のように錯体の生成反応(実際には(2)式の置換反応)を表した場合,この反応式の平衡定数を安定度定数といいます.複数の配位子が結合していく場合は,逐次安定度定数を(3a)のように定義し,この定義に従う安定度定数(K1,K2・・・)を逐次安定度定数といいます.また,別の定義の仕方もあります.これは(4)のように,複数配位子が入る場合に一度に複数の配位子を入れてしまうように反応式を書くやり方です.(実際にいちどきに反応してしまうわけではありませんが,形式的に反応式をこう書くのです).この場合の安定度定数は(4a)式のようになり,これを全安定度定数といいます.β1=K1, β2=K1×K2,β3=K1×K2×K3 ・・・のような関係式があるので,逐次安定度定数と,全安定度定数は相互に変換できます.安定度定数は対数で表示されることもよくあります.常用対数logで表示した安定度定数が10以上あるような場合は非常に結合しやすいことを示しています.
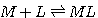 (3)
(3)
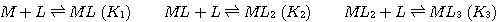
![]() (3a)
(3a)
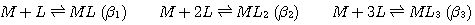 (4)
(4)
![]() (4a)
(4a)
一般に金属に同じ配位子が複数結合していく場合,K1>K2>K3>・・・のように安定度定数が次第に小さくなる関係式があります.このため,金属イオンの溶液に配位子を少しずつ加えていくと図に示すように順次ML,ML2,ML3が生成していく(もしK1<K2<K3であれば1つの配位子を持った金属はより配位子を持ちやすいことになり,1つの金属が多数の配位子を独り占めしていく結果となってしまう)のです.
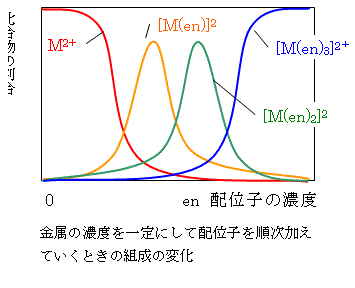
エチレンジアミンのような2座配位子は単座配位子に比べて安定度定数がはるかに大きい(表に示した例をみよ.エチレンジアミンが2個結合する反応の平衡定数は1014である.)ことが知られており,これはキレート効果と呼ばれています.
金属は,同じ元素でも多数の酸化数を持つものが多いことが特徴です.例えば鉄には+2,+3があり,銅には+1,+2があることはよく知られています.鉄や銅にはこれ以外の酸化数もありますし,非常に変わった酸化数を持つ金属化合物もあります.
[Fe(phen)3]3+ + [Fe(CN)6]4- → [Fe(phen)3]2+ + [Fe(CN)6]3- (5)
(5)式は,典型的な錯体の酸化還元反応であり,1,10-フェナンスロリン(phen)が配位した錯体が+3価から+2価に還元され,逆にシアノ配位子(CN)が配位した錯体が+2価から+3価に酸化されています.これは後者の錯体が酸化されやすいことによるのです.この反応(非常に速く進む)はどのようにして起こるのでしょうか.金属の酸化数が変わるのではなく,配位子が入れ替わると考えることも可能かもしれませんが,これらの錯体の配位子置換の速度はそれほど速くはないことが知られています.特にphenのついた錯体の置換はわりと遅いことが知られています.よってCNの錯体からphenの錯体へ電子が1個移動すると考えればいいことになります.このように単に電子が移動することによって生じる酸化還元反応を外圏反応といいます.
[Cr(H2O)6]2+ + [CoCl(NH3)5]2+ → [CrCl(H2O)5]2+ + [Co(NH3)5(H2O)]2+ (6)
これに対して(6)では,クロムの酸化数が+2から+3に酸化されるのと同時にCl-イオンがコバルトからクロムに移動しています.この場合には,前の例のように電子がまず移動すると考えると不自然です.なぜならば電子が移動するとクロムが酸化されて[Cr(H2O)6]3+が生成しますが,この錯体の置換反応はめちゃくちゃ遅いことが知られているからです.様々な研究の結果この場合はクロロ配位子が両方の金属に架橋配位した錯体が生成し,この架橋配位子を伝って電子が移動すると考えると良いことがわかりました.このような機構を内圏反応といいます.
このような外圏,内圏の考え方は生物の中の様々な酸化還元反応の理解に大変重要であることが示されているのです.
1)酸化的付加反応と還元的脱離

A−Bで表される分子(AとBは同じ元素でもよい)が,金属錯体と反応してA−B結合が切断し,AとBが金属に配位する反応.金属の酸化数と配位数がいずれも2増えるのが特徴の反応.その逆の反応が還元的脱離であり,金属の酸化数と配位数がいずれも2減少します.
A−Bの例としては,ハロゲン化アルキルR−X,H2,酸ハロゲン化物RCOXなどがります.
2) オレフィン挿入反応とβ脱離反応

オレフィンが金属−配位原子間に挿入する反応とその逆反応をいいます.前者はオレフィンの二重結合にM−Lが付加する反応と見ることもできます.また,逆反応の際は,金属から数えて2番目の原子(β位)似結合している水素などが解離して金属に配位するのでβ脱離といいます.
なお,オレフィンの代わりに一酸化炭素などC=C以外の二重結合を持った化合物が挿入することもあります.
ところで触媒反応は均一系反応と不均一系反応に分類されます.応用の観点から見ると不均一系反応の方が例は多いのですが,選択性が高いこと(望む反応生成物のみ作ること)や,反応機構の研究が比較的容易なことから,研究としては均一系反応も非常に多くなっています.
上で説明した反応と配位子置換反応などを組み合わせて,多くの触媒反応の機構を説明することができます.
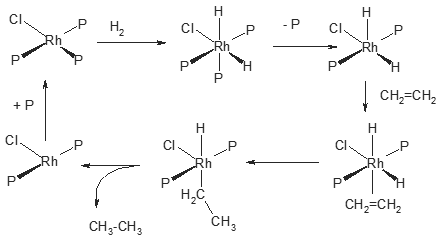
例えば上記はロジウム錯体を用いるオレフィンの水素化反応の反応機構を示したものです.最初(左上の図)から説明するとまず水素(H2)が酸化的に付加hし,ホスフィン配位子(P)が1つ脱離,そこにオレフィンが配位して右下の錯体になります.さらにRh−H結合にオレフィンが挿入してエチル基の配位した錯体となったあと,そのエチル基とヒドリド配位子が還元的に脱離し,2段階目ではずれたホスフィン配位子が戻ってきて最初の錯体が再生されます.その他の例は応用のところで説明します.